【光谱实验室:陈中博士 撰文】
【仪器设备:圆二色光谱仪】
【地点:4号楼220室 光谱实验室】
蛋白质是构成生物体的三大基础物质之一,机体所有重要的组成部分都需要蛋白质的参与。蛋白质是由氨基酸经“脱水缩合”的方式组成的多肽经过折叠形成的具有一定空间结构的物质。人体内蛋白质都是由20种氨基酸按不同比例组合而成,但是性质和生物功能各不相同,其原因与蛋白质的空间结构密切相关。确定蛋白质构象最准确的方法是X-射线晶体衍射,但对结构复杂、柔性的生物大分子蛋白质来说,得到所需的晶体结构较为困难。二维、多维核磁共振技术能测出溶液状态下较小蛋白质的构象,可是对分子量较大的蛋白质的计算处理非常复杂。
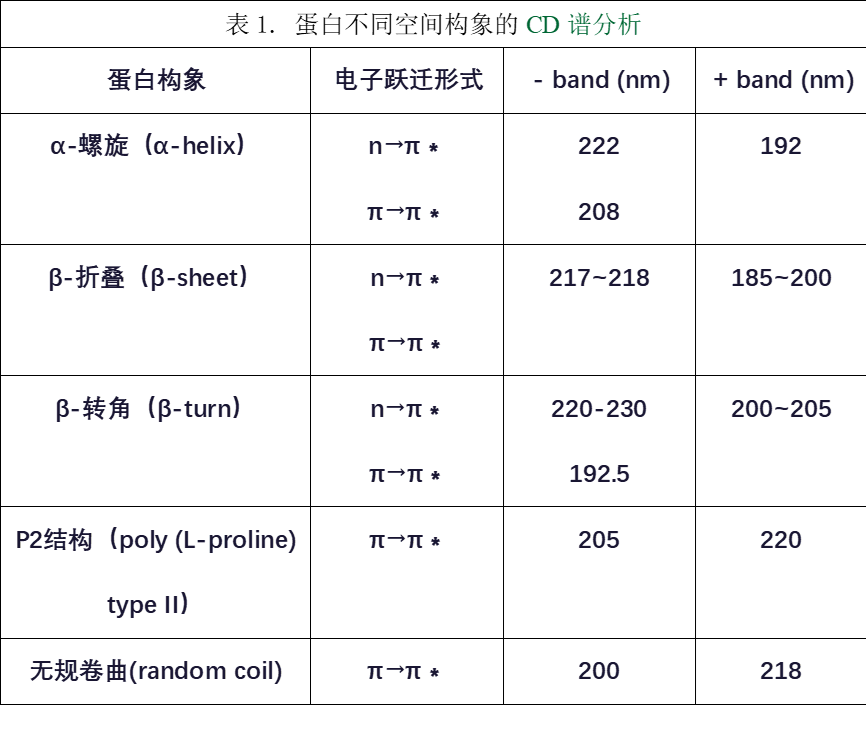
圆二色光谱(CD谱)是吸收光谱的差谱,通过测量蛋白质的CD谱,从而分析蛋白质大分子的二级结构,方法简单、快捷,广泛应用在蛋白质折叠,蛋白质构象研究,酶动力学等领域。研究蛋白质的二级结构中在CD谱紫外区段(180-260nm)有明显的信号,主要生色团是肽链,这一波长范围的CD谱包含了生物大分子主链构象的信息。如图1所示,α-螺旋构象的CD谱在222nm、208nm处呈负峰,在192nm附近有一正峰。β-折叠构象的CD谱在217-218nm处有一负峰,在185-200nm处有一强的正峰。β-转角在220-230 nm有一负带,在205 nm有一正带。P2结构的CD谱在205 nm附近有一负峰,在220 nm附近有一正峰。无规则卷曲构象的CD谱在200 nm附近有一负峰,在218nm附近有一小而宽的正峰。
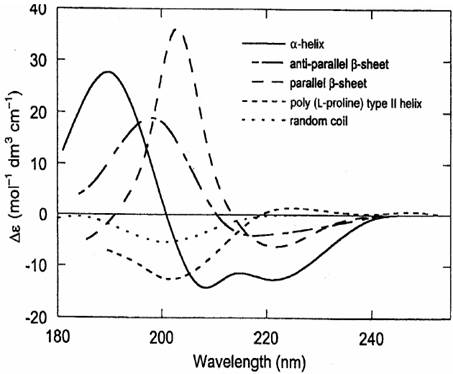
图1. 蛋白不同空间构象的CD谱曲线
蛋白质在一定的物理和化学条件(加热、加压、脱水、振荡、紫外线照射、超声波、强酸、强碱、尿素、重金属盐、十二烷基硫酸钠)下,其空间构象容易发生改变而失活,因此研究蛋白的构象和构型变化对其应用有重要的价值。蛋白质的变性作用主要是由于蛋白质分子内部的结构被破坏。天然蛋白质的空间结构是通过氢键等次级键维持的,而变性后次级键被破坏,蛋白质分子就从原来有序的卷曲的紧密结构变为无序的松散的伸展状结构(但一级结构并未改变)。热变性是蛋白质变性中最常见的一类现象,圆二色光谱仪配套温控装置可以研究蛋白热变性过程,并通过软件拟合直接获取蛋白质的热变性中温度Tm值和记录整个热变性过程,对研究蛋白组分的热稳定性及在外界环境改变时的变性过程具有重要的科学价值。
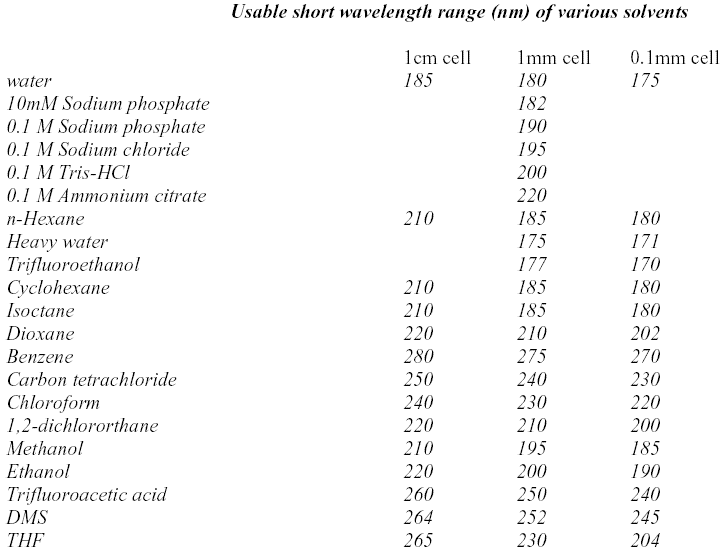
蛋白的热变性测试过程通常是在温度程序变化条件下观测蛋白质的CD谱,在进行变温实验之前,宜先测试待测蛋白的静态CD谱。蛋白溶液的测试有时需要在缓冲溶液中进行,但是不是所有的缓冲溶液都适合做CD谱的低波长测试,有些缓冲溶液的成份在短波区具有很强的吸光性,会对蛋白信号造成很大的干扰。一般常用的缓冲溶液如下,(1)磷酸钾缓冲溶液,可加入KF, K2SO4 或 (NH4)2SO4 这几类盐,(2) 2 mM 左右Hepes溶液,(3) 10 mM左右的醋酸铵。尽量避免使用Tris, NaCl及具有光学活性的成份,比如谷氨酸酯等。下面总结了一些常用的化学试剂的在短波区的吸收情况。
表2. 各种溶剂的CD谱测试适用范围
下面以实验室最常用的牛血清蛋白(BSA)为例,介绍蛋白样品的热变性测试过程及分析。
(一) 蛋白热变性实验的浓度优化
为了选择合适蛋白浓度进行热变性实验,我们配置了从0.01mg/ml至1mg/ml的5 种浓度的蛋白,分别测试他们的吸光度值和CD值。
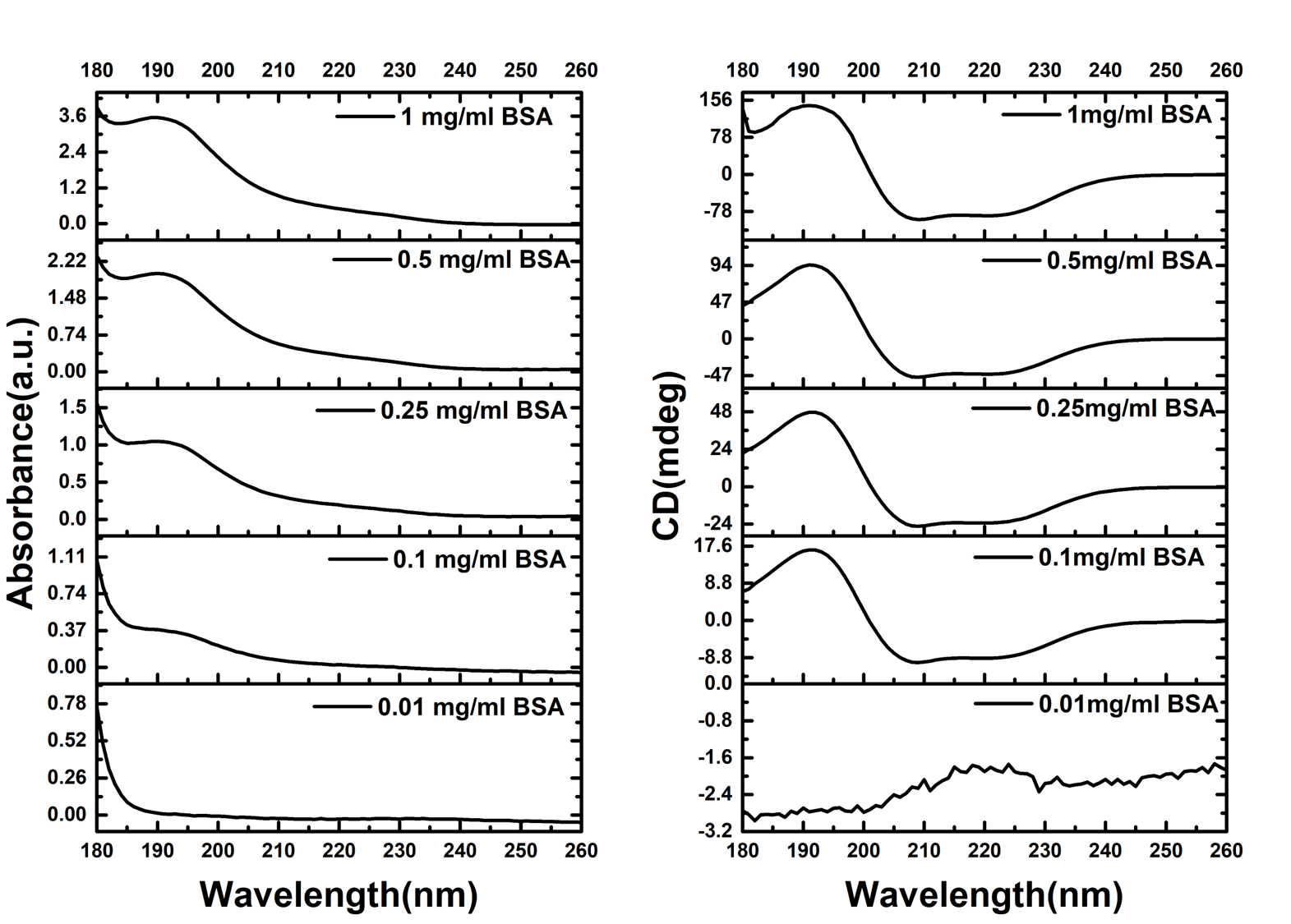
图2. BSA蛋白的不同浓度的吸光度和圆二色光谱曲线
如图2所示,当蛋白浓度在0.1 mg/ml至0.5 mg/ml时,吸光度值在0.4至2左右,此区间是测试CD谱的最佳范围,对应的CD谱曲线除强度不同,形状完全一致。当蛋白浓度低于0.01mg/ml,宜采用大光程的比色皿进行测试如1mm,或者2mm光程的比色皿。当蛋白浓度在1mg/ml的量级上,其吸光度在3.5左右,吸光度值过于饱和,在CD谱上可见180 nm附近的曲线方向与其他三个稍有不同,尽管如此,我们的仪器仍然可以测出蛋白的CD谱。我们将有CD信号的四个浓度的蛋白进行热变性实验。同时监控它们的吸光度和CD谱曲线的变化。
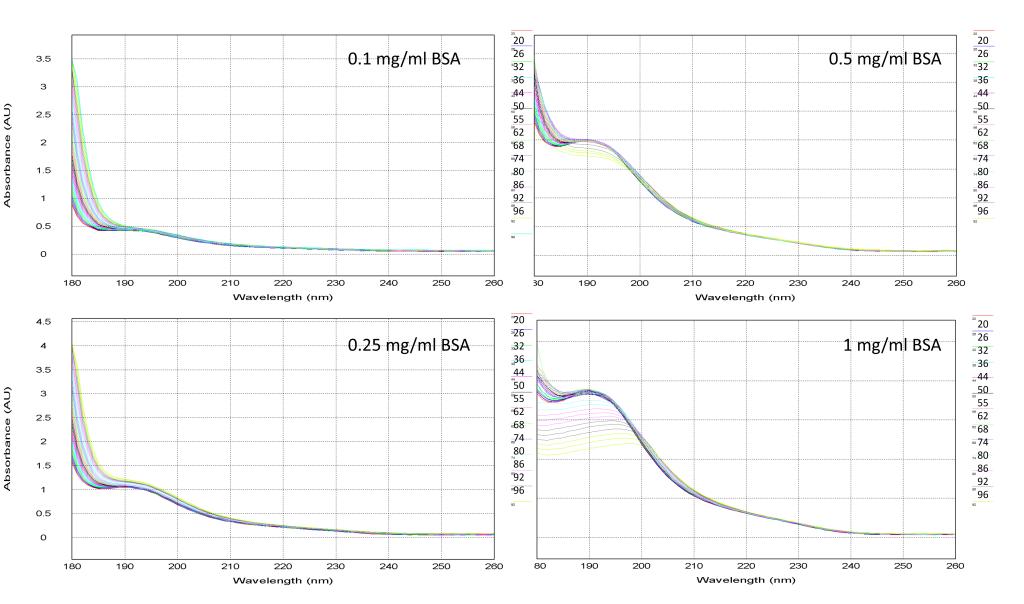
图3. BSA蛋白四种浓度热变性的吸光度曲线
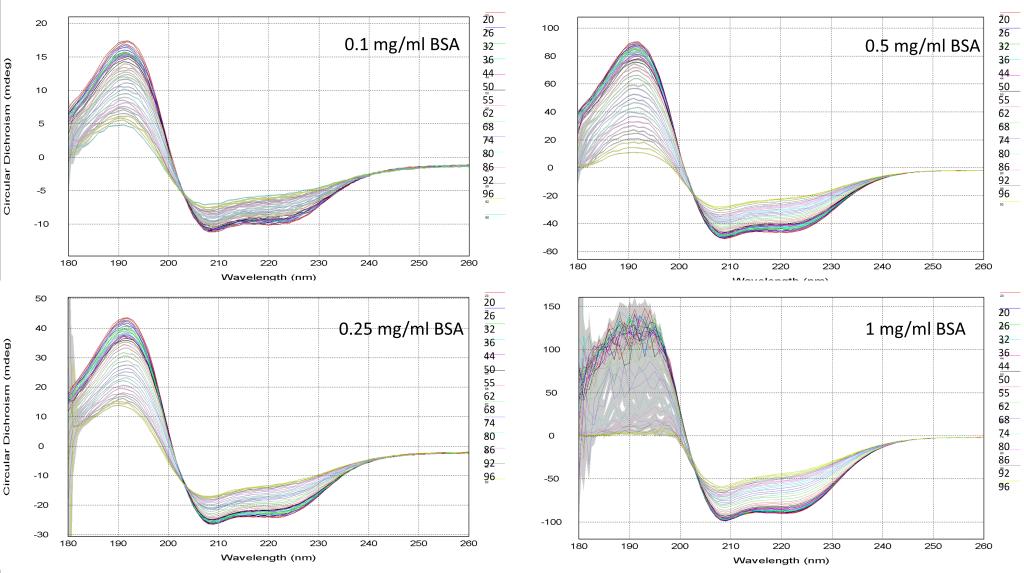
图4. BSA蛋白四种浓度热变性的CD谱
通过图3的吸光度曲线分析,我们可以看出BSA蛋白的吸光度在0.1mg/ml和0.25mg/ml时随着温度的升高变化较小,在0.5 mg/ml时变化较大,而1 mg/ml时变化明显。图4的CD谱曲线表明当蛋白浓度小于1 mg/ml时,蛋白的热变性趋势接近一致,而1mg/ml的蛋白由于吸光度较大,CD谱曲线在高吸光度区域出现大幅度抖动,不适于进行研究蛋白二级结构的热变性实验。
(二) 蛋白热变性构象的软件分析
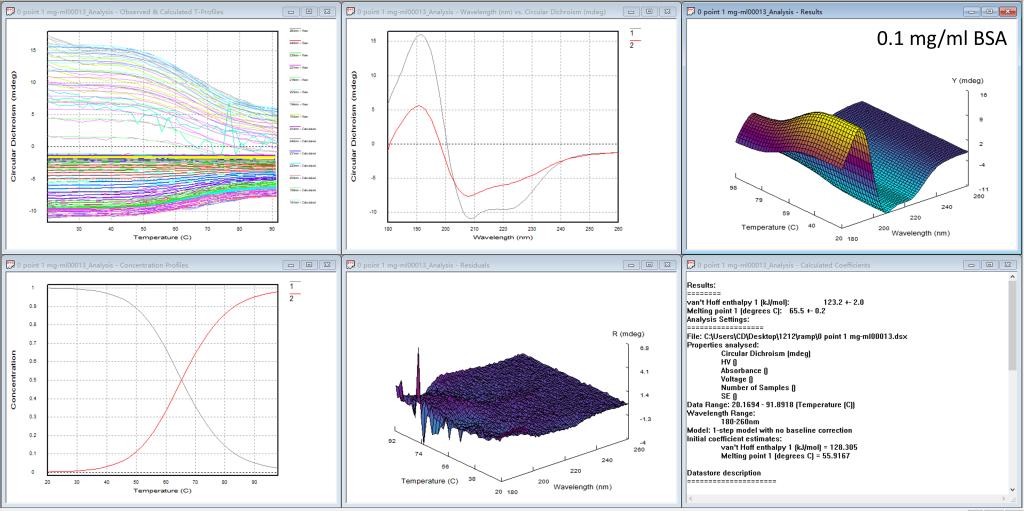
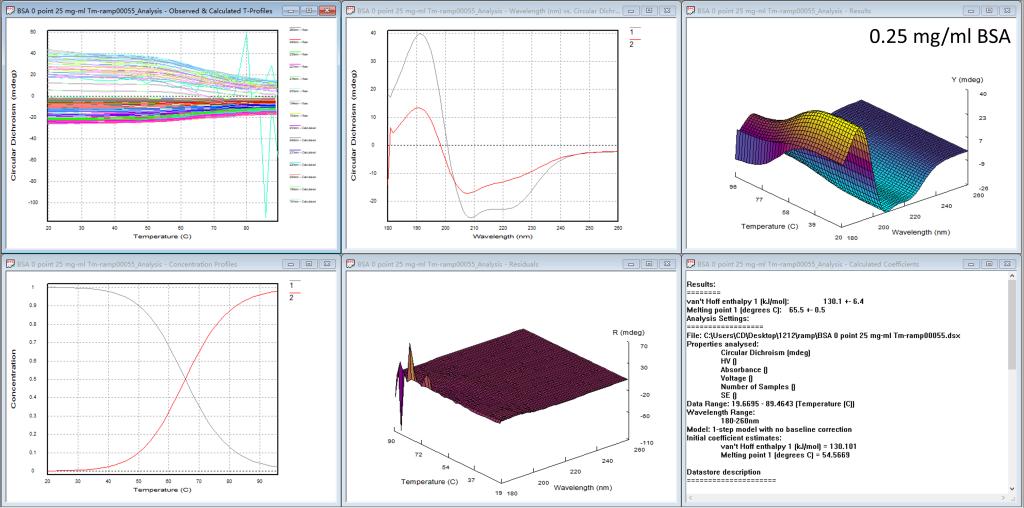
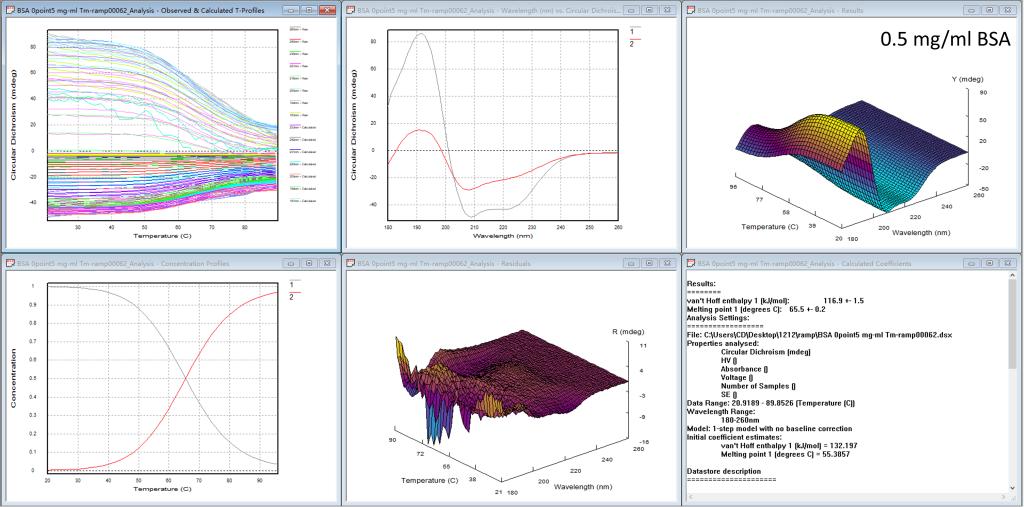
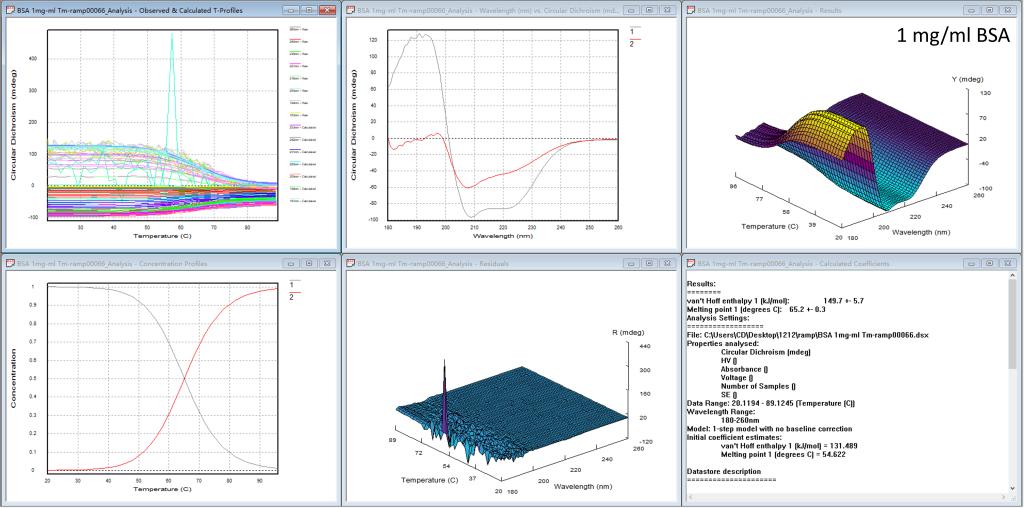
图5. Global3软件分析BSA蛋白四种浓度热变性的结果
当测完一组蛋白的热变性实验后,我们的仪器上还提供热变性分析软件,如图5的每一个图都有6个小窗口,从左上方到右下方依次为1)每个波长的变温曲线,2)计算出的独立的、有意义的光谱(比如起始图谱、变性后的图谱),3)计算出的温度-波长CD三维图,4)计算出的浓度分布作为温度的函数,5)噪音三维图,6)计算出的热力学参数(最重要的Tm值)。研究人员可根据实验需要,系统地分析蛋白的热变性过程。前三种浓度BSA的热变性实验结果表明此蛋白的Tm值在65.5℃;所以只要吸光度在合适的区间(0.2 < A < 3),Tm值不受浓度的影响。
除了热变性分析软件,我们还提供CDNN软件做蛋白构象的分析,我们从热变性的蛋白中选择起始状态(20 ℃),中间状态(55 ℃)和最终状态(96 ℃)的三个温度,用软件计算其蛋白的二级结构。图6的结果可以看到,BSA 蛋白最初的状态是螺旋态为主,热变性后螺旋向转角和无规卷曲逐渐变化,CD谱的强度下降,主要构象从α螺旋向β转角和无规卷曲转化。
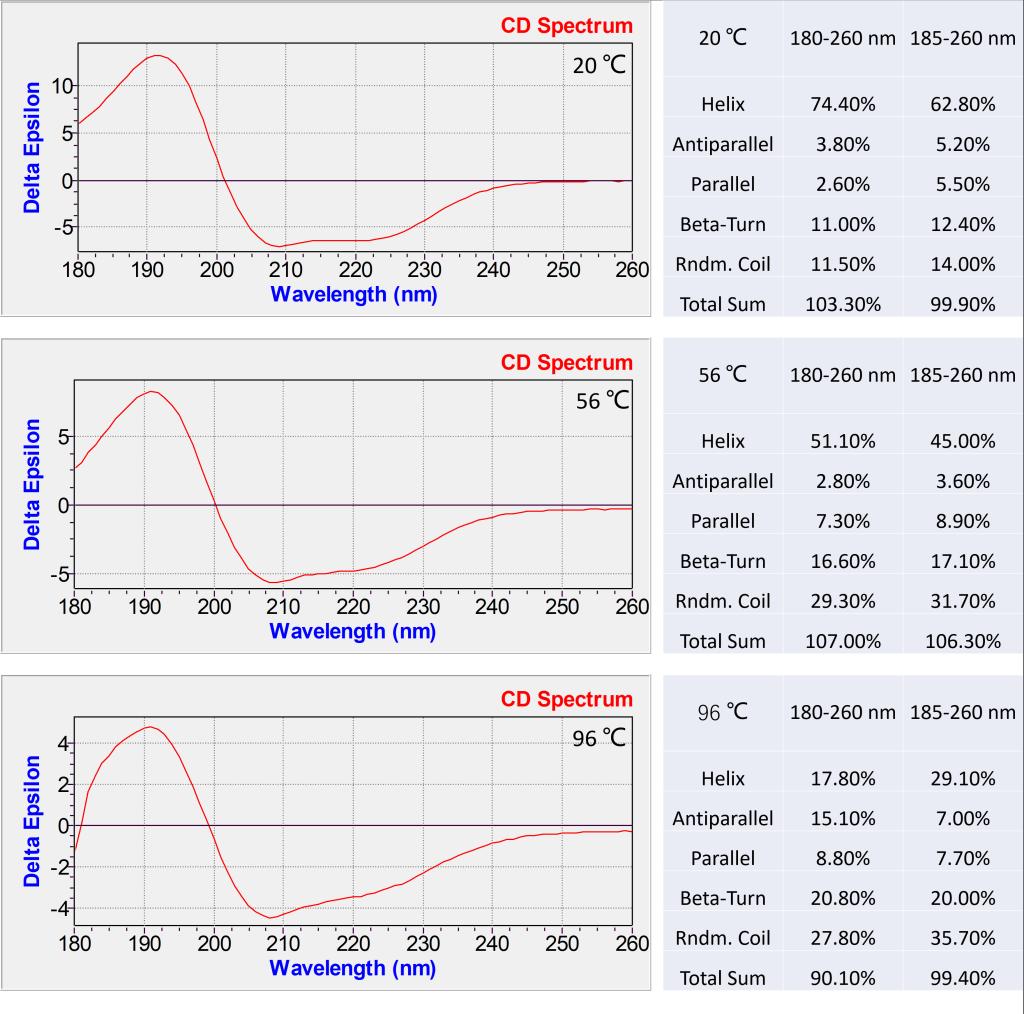
图6. BSA蛋白构象CDNN软件分析结果
(三) 其他蛋白的热变性测试分析
除了BSA蛋白外,我们还尝试用人体血红蛋白(HbC)进行热变性实验,根据上述的测试结果,血红蛋白的浓度选用0.25 mg/ml进行测试。
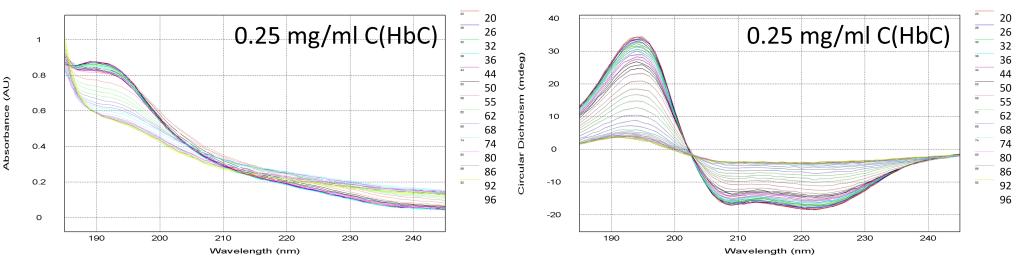
图7. HbC蛋白热变性测试结果
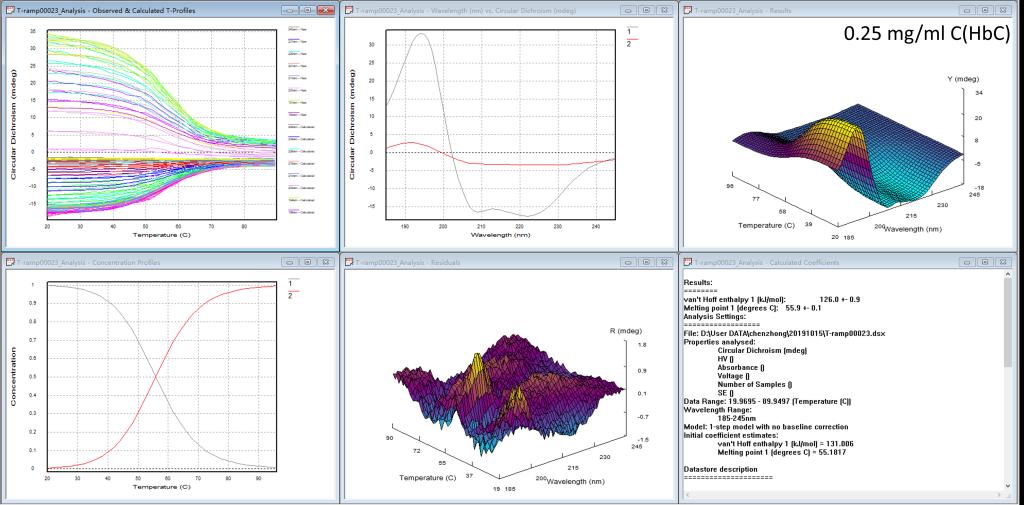
图8. Global3软件分析HbC蛋白热变性的结果
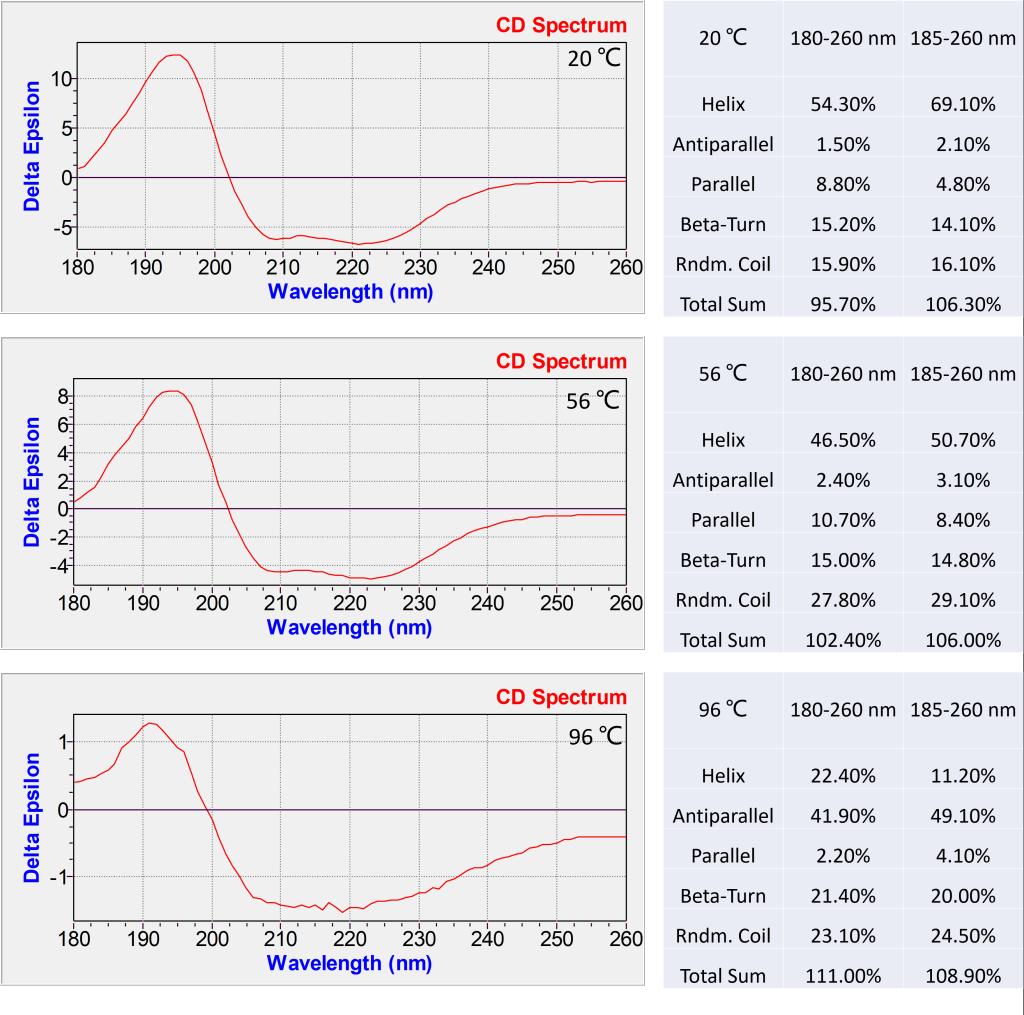
图9. HbC蛋白构象CDNN软件分析结果
测试结果如图7所示,相比于BSA血清蛋白,血红蛋白的热变性过程更加明显,当温度在96℃时,蛋白的CD信号非常微弱,剧烈的热变性过程表明此蛋白对于温度变化更加敏感。从图8的Global 3软件可以分析出此血红蛋白的Tm值55.9℃,略低于前面的血清蛋白,也说明血红蛋白的热稳定性相对血清蛋白较差。图9的CDNN的分析结果与血清蛋白类似,随着温度上升,同样是发生从α螺旋向β转角和无规卷曲的构象转化。
(四) 单波长测试对比
上述的结果我们都是基于蛋白二级结构区间的全波长采集所得的结论, 全波长的分析结果需要Global3软件的支持,但文献上通常仪器是不一样的,有时需要与其他仪器的测试结果对比时,结果难以统一。而单波长采集模式可以在任何软件上进行拟合,也是一种很常用的分析方法。下面我们以BSA(0.25 mg/ml)为例,进行一组蛋白热变性单波长法的测试。如下图所示,我们根据全谱曲线选出三个极值点(191nm、208nm、222nm),一个随机点(235 nm),一个端点(260 nm)和一个特殊的交叉点(203nm),分别做6个单波长蛋白热变性曲线。数据经拟合如下面的图表所示,在所有的极值点的Tm值都在65℃~66℃,中间随机点也在65℃~66℃,端点有两个值分别在的在54℃和80℃附近,特殊交叉点在52℃左右。所以单波长测试的与选点有很大关系,选取的3个极值点的结果都是一致的,与全谱所测的Tm值几乎相等,因为极值点反应的是蛋白构象对温度最敏感的部分,中间任意点只要有足够的变化,也能正确反应热变性的过程,只有变化小的特殊点和几乎不变化的端点会给出错误信息(拟合的曲线方程不相同),所以采用单波长测试时尽量选择变化大的点更能反应蛋白结构的真实信息。
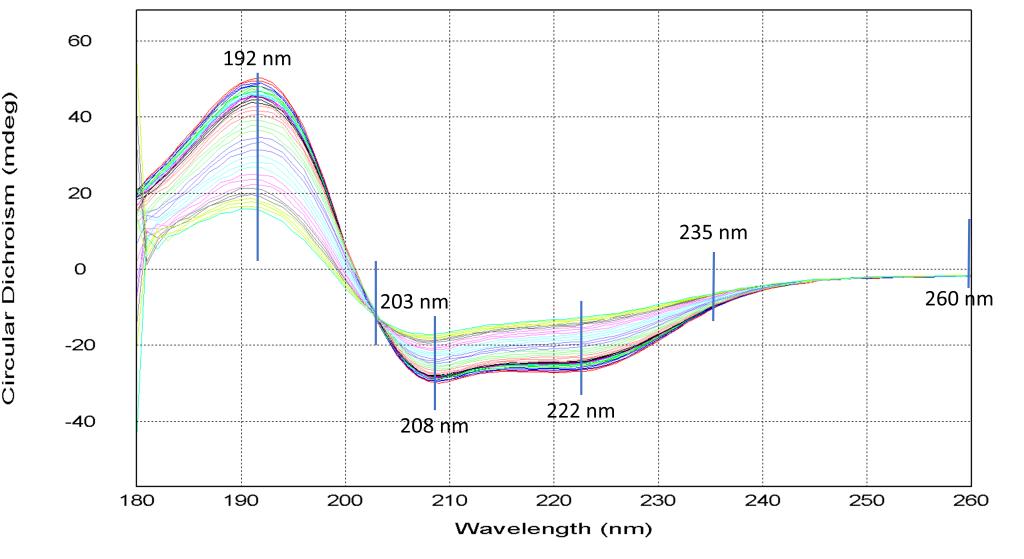
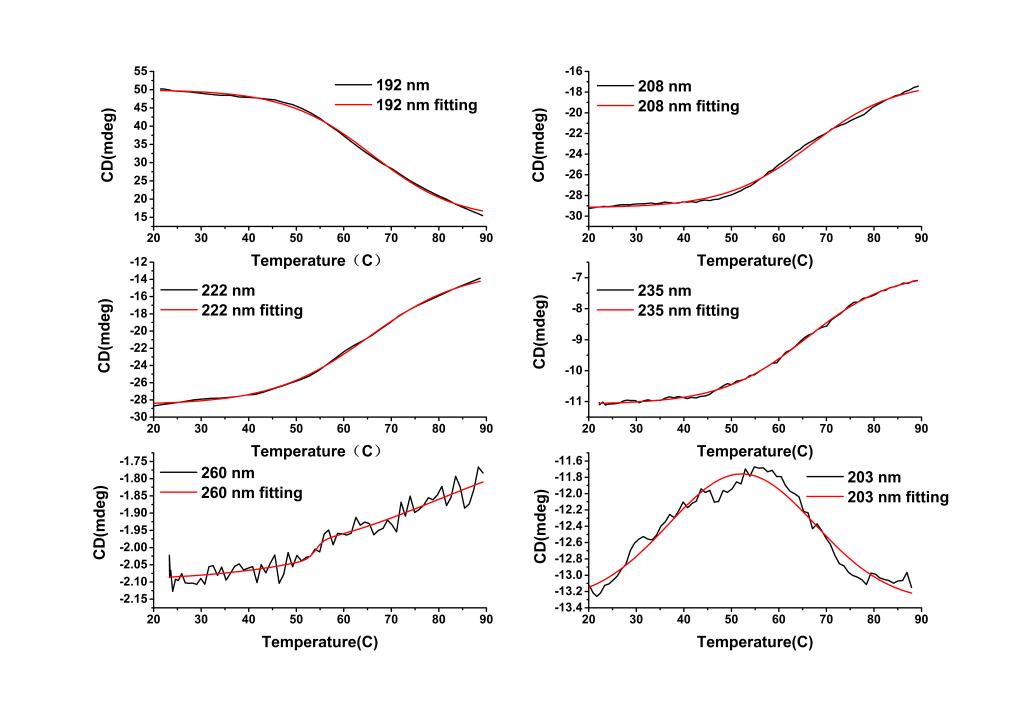
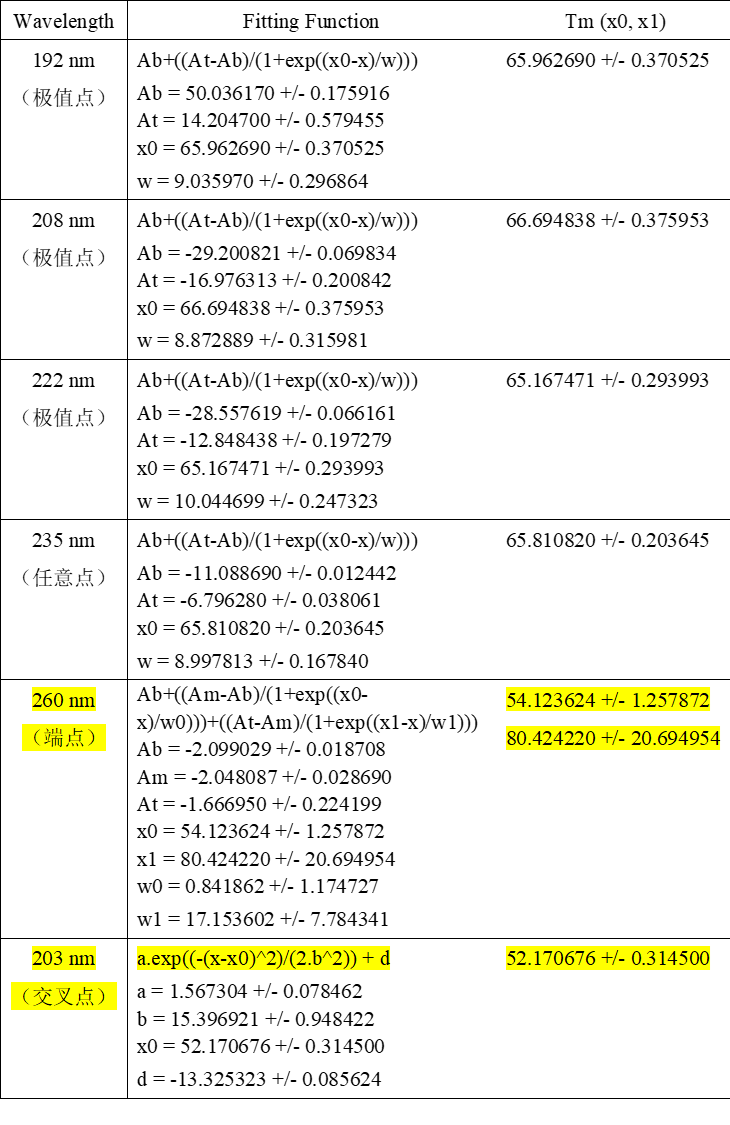
图10. 全谱上选择六个代表性点分别作热变性测试及拟合的结果
(五) 总结
以上是光谱实验室技术员所做的蛋白热变性测试的Demo实验,从实验中我们总结出以下几点:
1. 当吸光度在合适的范围内,蛋白的热变性温度(Tm值)不受浓度的影响;
2. 不同的蛋白的热稳定性不同,Tm值低的蛋白对热变化更敏感一些;
3. 测试蛋白热变性的升温速率都是1℃/min,所以全波长测试所花的时间和单波长测试的时间是一样的,而全波长能反应蛋白在所有波长段的热稳定性状况,更有利于了解蛋白的整体热变性过程,如果仪器配套了全波长测试分析软件,建议研究人员选用全波段测试模式。单波长测试侧重于某一特定波长的变化,如果为了和其他数据进行对比必须选择单波长测试模式,建议选择极值点作为测试波长。
此外,圆二色光谱仪不仅能用于蛋白结构的分析,其他手性材料的构象分析也同样适用,比如DNA,聚合物,手性晶体等。
理化平台光谱实验室的Chirascan V100 配置Quantum 电子控温系统(-40℃~150℃)和全波长测试分析软件,能方便地进行蛋白热变性的实验,帮助研究人员全面地了解蛋白的构象。今后我们还将推出光谱仪器的其他demo实验及分析,节省研究人员的很多预实验过程,提供最优质的仪器和技术支撑西湖大学的科研。
参考资料:
[1] 王克让,李小六,圆二色谱的原理及其应用, 科学出版社, 2017